PROCESO INDUSTRIAL DE HIPOCLORITO DE SODIO
jueves, 2 de julio de 2015
Impactos en el ambiente de las moleculas de Cl en el NaOCl
AIRE
SUELO
En condiciones atmosféricas naturales el Cloro está presente en la atmósfera en niveles muy bajos o insignificantes así
que la manera en la cual se dan concentraciones peligrosas de Cloro en el aire obedece directamente a fuentes
humanas, de esta manera, la emisión de Cloro gaseoso se da en la mayoría de los casos por accidentes o malos
funcionamientos en instalaciones que lo usan o producen (7, 12)
.
En la atmósfera, el Cloro no posee una vida muy prolongada en su estado basal. Inicialmente, alguna cantidad
del Cloro liberado reacciona con humedad produciendo Acido Clorhídrico y Acido Hipocloroso, estos dos compuestos
se lavan de la atmósfera con por medio de la lluvia interviniendo en los fenómenos de lluvia ácida. Otra
cantidad de Cloro reacciona con Hidrógeno atmosférico en una reacción iniciada por energía solar dando lugar
al Acido Clorhídrico. Los compuestos de Cloro que no siguen la vía de la lluvia ácida reaccionan con gases y
vapores básicos atmosféricos y con material suspendido generando aerosoles particulados que se precipitan a
tierra o permanecen suspendidos haciendo parte de la contaminación atmosférica conocida como smog. Finalmente,
el Cloro que no se ha transformado por las vías anteriores interviene en la formación y destrucción de
ozono a nivel de la troposfera
AGUA
Existen diferentes maneras por las cuales el Cloro puede alcanzar las vías de agua, no obstante, en la mayoría de los
casos los niveles son tan bajos que no tienen efectos graves sobre organismos que entran en contacto con las vías de
agua contaminadas. Gracias a sus propiedades desinfectantes, funguicidas y de modificación de pH, el Cloro y otros
de sus compuestos como el hipoclorito de Sodio, se adicionan al agua en concentraciones controladas en piscinas
así como en las últimas etapas de procesos de potabilización. Una porción del Cloro que escapa en derrames o
emisiones a la atmósfera se lava de ella por acción de la lluvia formando parte de la lluvia ácida, pero en general el
aporte de esta sustancia a los efectos ácidos es mínima (cerca del 1% (12)) en parte por que es poco soluble en agua
y en parte por la marcada presencia de otras sustancias como los óxidos de Azufre y de Nitrógeno. La entrada de Cloro
a fuentes de agua por causa de derrames es poca debido a su alta volatilidad una vez se encuentra en condiciones
de temperatura y presión atmosféricas. Sin embargo, compuestos de Cloro con características irritantes, solubles en
agua si poseen un alto riesgo para la vida acuática
SUELO
Teniendo en cuenta que el Cloro es un gas, es muy rara su presencia en el suelo, pero si se libera por causa de derrames
o fugas reacciona con la humedad allí presente formando Acido Hipocloroso y Acido Clorhídrico. Posteriormente estos
compuestos reaccionan con otras sustancias que se encuentran en el suelo formando en su mayoría Cloruros. El Cloro
en sus formas derivadas a partir de la reacción con la humedad no se acumula en las cadenas alimenticias
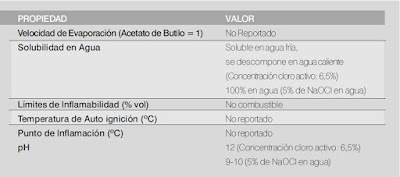
Características Físicas y Químicas del Hipoclorito de Sodio
Propiedades Físicas
Fuente: http://www.siame.gov.co/siame/GuiasAmbientales/tabid/57/Default.aspx
Propiedades Químicas
En general, los Hipocloritos son agentes oxidantes fuertes, con mayor fuerza que el peróxido de Hidrógeno o el Dióxido de Cloro. Su carácter de oxidante fuerte le permite actuar como agente de blanqueo y desinfección; estas propiedades se aprovechan para el tratamiento de fibras y la eliminación de microorganismos en el agua.
Las soluciones de Hipoclorito de Sodio caen dentro de dos clasificaciones: blanqueadores de uso doméstico, que contienen entre 5 y 5.5% de Cloro disponible, y soluciones fuertes o comerciales, que contienen entre 12 y 15% de Cloro disponible . El término “contenido de Cloro disponible”, también denominado Cloro activo y compara el poder oxidante del agente con aquel de la cantidad equivalente de Cloro elemental empleado para hacer la solución. Las soluciones de Hipoclorito de Sodio se descomponen en dos maneras: a Cloruro de Sodio (NaCl) y Oxígeno (O2) (reacción 1), o por desproporcionamiento a Cloruro de Sodio y clorato de Sodio (NaClO3) (reacción 2):
La última de estas dos reacciones ocurre en dos pasos: un paso lento inicial en que se forma el clorito de Sodio (NaClO2) (reacción 3), y un paso rápido de desproporcionamiento entre el Hipoclorito y el clorito (reacción 4):
El Hipoclorito de Sodio puede reaccionar también con Acido Hipocloroso (reacción 5), así:
Esta última ecuación se emplea con frecuencia para enfatizar el hecho de que en medio Ácido, el Hipoclorito se descompone con mayor facilidad que en medio básico, razón por la cual las soluciones de Hipoclorito de Sodio se mantienen a pH 11. En las soluciones de Hipoclorito de Sodio se da un balance dinámico, que se representa por la siguiente ecuación (reacción 6):
De acuerdo con un estudio acerca del mecanismo de acción del Hipoclorito de Sodio sobre microorganismos, éste compuesto actúa como un solvente de materia orgánica, específicamente de Acidos grasos, a quienes transforma en sales de Acidos grasos (jabones) y glicerol (C3H8O3), reduciendo la tensión superficial de la solución remanente. Además, el Hipoclorito de Sodio neutraliza los aminoAcidos, formando agua y sales. Con la disminución de iones Hidroxilo (OH-) mediante la formación de agua, se reduce el pH, estimulando la presencia de Acido Hipocloroso que en contacto con componentes orgánicos actúa como solvente, libera Cloro que se combina con el grupo amino de las proteínas, formando cloroaminas. El Acido Hipocloroso y los iones Hipoclorito (OCl-) llevan a la degradación e hidrólisis de aminoAcidos.
Balance de materia hipoclorito de sodio

Proceso de producción de hipoclorito de sodio. Planta de Electrolisis
Fuente: http://sinat.semarnat.gob.mx/dgiraDocs/documentos/jal/estudios/2007/14JA2007I0003.pdf
La reacción global que se lleva a cabo es la siguiente:

- En la etapa de resaturación se prepara salmuera a la concentración requerida utilizando para esto sal y agua. También se utiliza tiosulfato de sodio para eliminar el cloro. La salmuera preparada se envía a tanque de almacén a través de filtro de arena el cual se lava con agua y genera agua residual.
- La salmuera se pasa a un proceso de purificación donde con sosa y carbonatos reacciona y se le bajan los contaminantes a lo especificado. De esta fase del proceso, se generan lodos blancos los cuales se mandan a confinar. La salmuera se filtra utilizando arena sílica, catolita, carbón activado y resinas de intercambio iónico antes de pasar a su tanque de almacén. Los filtros después de utilizar se lavan y genera agua residual.
- La salmuera purificada y agua es alimentada al sistema y posteriormente se hace pasar energía eléctrica a las celdas electrolíticas para la producción del cloro gas, posteriormente el gas se envía por tuberías para hacerlo reaccionar con la sosa, para formar el hipoclorito de sodio a la concentración requerida y conducirlo hacia el tanque de almacenamiento. de este proceso sale salmuera agotada la cual se pasa a una etapa de desclorinación donde se recupera el cloro libre y se envía por gravedad a las pilas de re-saturación.
Usos y aplicaciones del hipoclorito de sodio
La principal aplicación del hipoclorito de sodio es la desinfección y demás se utiliza como blanqueador de ropa, sin embargo sus aplicaciones van más allá de esos dos aspectos, como se mencionan a continuación:
- Desinfección de material quirúrgico y de algunos alimentos, tales como frutas y verduras.

Fuente: Quiminet Esterilización de material quirúrgico y demás herramientas que requieren de un alto grado de esterilización para su uso y aplicación.- Liberación de toxinas en sustratos.
- Decoloración de telas.
- Deodorización, purificación y tratamiento de aguas residuales, industriales, potables y de piscinas.
- Lavado de ropa como blanqueador.
- Mediante el proceso de electrólisis se convierte la sal presente en el agua en hipoclorito de sodio para desinfectarla.
- También es utilizado como fungicida y en la eliminación de bacterias.
Tomado de: Quiminet
lunes, 29 de junio de 2015
Características del Hipoclorito de Sodio
El hipoclorito de sodio es una solución clara de ligero color amarillento y un olor característico. El hipoclorito de sodio tiene una densidad relativa de 1,1 (5,5% solución acuosa). Como agente blanqueador de uso domestico normalmente contiene 5% de hipoclorito de sodio (con un Ph de alrededor de 11, es irritante). Si esta a mayor concentración, contiene un 10 a 15% de hipoclorito de sodio (con un Ph alrededor de 13, se quema y es corrosivo).
Hipoclorito de sodio es inestable. El cloro se evapora a razón de 0,75 gramos de cloro activo por día desde la solución. Después calentado el hipoclorito de sodio se desintegra. Esto también ocurre cuando hipoclorito de sodio contacta con ácidos, luz del día, ciertos metales y venenos así como gases corrosivos, incluyendo el gas de cloro. El hipoclorito de sodio es un oxidante fuerte y reacción con compuestos combustibles y reductores. El hipoclorito de sodio es una base débil inflamable. Estas características se deben tener en cuenta en los procedimiento de transporte, almacenamiento y uso del producto.
Suscribirse a:
Comentarios (Atom)