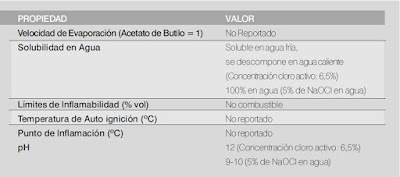
Propiedades Físicas
Fuente: http://www.siame.gov.co/siame/GuiasAmbientales/tabid/57/Default.aspx
Propiedades Químicas
En general, los Hipocloritos son agentes oxidantes fuertes, con mayor fuerza que el peróxido de Hidrógeno o el Dióxido de Cloro. Su carácter de oxidante fuerte le permite actuar como agente de blanqueo y desinfección; estas propiedades se aprovechan para el tratamiento de fibras y la eliminación de microorganismos en el agua.
Las soluciones de Hipoclorito de Sodio caen dentro de dos clasificaciones: blanqueadores de uso doméstico, que contienen entre 5 y 5.5% de Cloro disponible, y soluciones fuertes o comerciales, que contienen entre 12 y 15% de Cloro disponible . El término “contenido de Cloro disponible”, también denominado Cloro activo y compara el poder oxidante del agente con aquel de la cantidad equivalente de Cloro elemental empleado para hacer la solución. Las soluciones de Hipoclorito de Sodio se descomponen en dos maneras: a Cloruro de Sodio (NaCl) y Oxígeno (O2) (reacción 1), o por desproporcionamiento a Cloruro de Sodio y clorato de Sodio (NaClO3) (reacción 2):
La última de estas dos reacciones ocurre en dos pasos: un paso lento inicial en que se forma el clorito de Sodio (NaClO2) (reacción 3), y un paso rápido de desproporcionamiento entre el Hipoclorito y el clorito (reacción 4):
El Hipoclorito de Sodio puede reaccionar también con Acido Hipocloroso (reacción 5), así:
Esta última ecuación se emplea con frecuencia para enfatizar el hecho de que en medio Ácido, el Hipoclorito se descompone con mayor facilidad que en medio básico, razón por la cual las soluciones de Hipoclorito de Sodio se mantienen a pH 11. En las soluciones de Hipoclorito de Sodio se da un balance dinámico, que se representa por la siguiente ecuación (reacción 6):
De acuerdo con un estudio acerca del mecanismo de acción del Hipoclorito de Sodio sobre microorganismos, éste compuesto actúa como un solvente de materia orgánica, específicamente de Acidos grasos, a quienes transforma en sales de Acidos grasos (jabones) y glicerol (C3H8O3), reduciendo la tensión superficial de la solución remanente. Además, el Hipoclorito de Sodio neutraliza los aminoAcidos, formando agua y sales. Con la disminución de iones Hidroxilo (OH-) mediante la formación de agua, se reduce el pH, estimulando la presencia de Acido Hipocloroso que en contacto con componentes orgánicos actúa como solvente, libera Cloro que se combina con el grupo amino de las proteínas, formando cloroaminas. El Acido Hipocloroso y los iones Hipoclorito (OCl-) llevan a la degradación e hidrólisis de aminoAcidos.




No hay comentarios:
Publicar un comentario